Une avancée thérapeutique préventive contre les migraines
Deux essais cliniques viennent de montrer que des anticorps thérapeutiques sont efficaces pour réduire la fréquence des crises chez des sujets migraineux, sans effet indésirable notable. Cependant, le maintien de leur efficacité ainsi que l’absence d’effets indésirables sur long terme doivent encore être évalués avant leur éventuelle mise sur le marché.
La migraine : état des lieux
La migraine est une maladie neurologique présentant comme symptômes des maux de tête récurrents. La douleur est fréquemment associée à des nausées, des vomissements et une hypersensibilité à la lumière et au bruit. Sa prévalence est très élevée puisqu’elle affecte la qualité de vie d’au moins 8 millions de personnes en France, en majorité des femmes. Son coût sociétal (arrêts de travail, diminution de la productivité) est important, même si des traitements efficaces de la crise migraineuse existent aujourd’hui pour la majorité des personnes qui en souffrent. En revanche, les thérapies préventives disponibles sont peu efficaces et mal tolérées. Deux études publiées récemment dans le New England Journal of Medicine laissent à penser que des progrès significatifs pourraient intervenir prochainement en matière de prévention des crises et donc dans la qualité de vie des personnes migraineuses.
Une avancée thérapeutique en cours d’essai
Des études précédentes avaient révélé l’implication d’une protéine, le CGRP (Calcitonin Gene Related-Peptide), dans la crise migraineuse. Le CGRP est à la fois un vasodilatateur, qui augmente le diamètre des vaisseaux sanguins en particulier au niveau des enveloppes du cerveau, et un médiateur de la douleur. Cette double action est à l’origine du déclenchement de la crise migraineuse.
Dans ces deux nouveaux essais cliniques de phase 3 (voir encart à droite), des molécules synthétiques, plus précisément des anticorps, ont été utilisées. Un premier anticorps, le Fremanezumab, se fixe sur le CGRP et empêche son action sur ses récepteurs. Le deuxième anticorps, appelé Erenumab, se fixe sur les récepteurs eux-mêmes empêchant toute action du CGRP à leur niveau. Ainsi, aussi bien avec l’un ou l’autre de ces anticorps, on supprime à la fois l’effet vasodilatateur et l’effet « pro-douleur » du CGRP. Et dans les deux cas, l’injection mensuelle sous-cutanée de l’anticorps, sur une période de 4-6 mois, a diminué de 40-50% le nombre de crises migraineuses chez plusieurs centaines de patients.
Ces résultats sont très prometteurs mais il convient encore de s’assurer du maintien de l’action anti-migraineuse à long terme des anticorps, et aussi de la bonne tolérance à leur administration répétée, c’est-à-dire à l’absence de toute toxicité et effets secondaires gênants.
Publications : Silberstein SD et coll. Fremanezumab for the Preventive Treatment of Chronic Migraine. N Engl J Med., 2017;377 :2113-2122.
Goadsby PJ et coll. A Controlled Trial of Erenumab for Episodic Migraine. N Engl J Med. 2017 ; 377:2123-2132.
Rédaction : Laura Gouder avec la contribution de Michel Hamon
Photo en une : Nombre_Genérico
_____
Pour recevoir les actualités de la recherche, inscrivez-vous à notre newsletter :
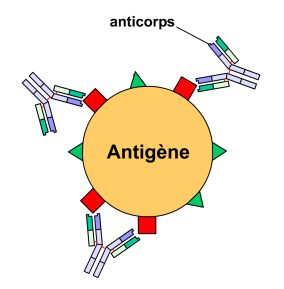
Qu’est-ce qu’un anticorps ?
Ce sont des protéines (globulines) produites par des cellules du système immunitaire. Leurs extrémités reconnaissent de façon spécifique des structures moléculaires appelées antigènes, qui peuvent être portées par des agents pathogènes (bactéries, virus, protéines étrangères). Ils s’y fixent, ce qui permet aux cellules du système immunitaire de reconnaitre l’agent pathogène pour ensuite le détruire. Des anticorps spécifiques reconnaissant un seul antigène ont pu être produits à des fins thérapeutiques.
© Yohan, Wikimedia, licence GFDL GNU 1.2 Légende : Schéma d’un anticorps reconnaissant un antigène.
En quoi consistent les différentes phases cliniques de développement d’un médicament ?
Phase 1 : Évaluation de l’absence de toxicité de la molécule chez le sujet sain. Après les études précliniques (in vitro et in vivo chez l’animal) qui ont révélé un intérêt thérapeutique potentiel, la molécule est administrée chez un petit nombre de sujets sains pour s’assurer de l’absence d’effet toxique aux doses envisagées pour obtenir l’action thérapeutique.
Phase 2 : Vérification et évaluation de l’efficacité de la molécule. Elle est administrée chez un petit nombre de sujets atteints de la maladie sur laquelle elle est censée agir. Cette étape permet de déterminer la posologie adéquate pour un traitement efficace mais de durée limitée dans le temps.
Phase 3 : Cette étape est réalisée sur un grand nombre (plusieurs centaines voire plusieurs milliers) de patients, dans les conditions susceptibles d’être retenues pour le traitement en population générale. Elle va consister en une comparaison avec un médicament efficace déjà présent sur le marché et/ou avec un placebo. Cette étape permet aussi d’évaluer le rapport bénéfice/risque du traitement avec la nouvelle molécule. Ce n’est qu’après validation de cette étape qu’une molécule peut obtenir l’« Autorisation de Mise sur le Marché » (AMM) et être commercialisée comme médicament.
Phase 4 : Suivi après mise sur le marché du médicament. Cela permet de révéler d’éventuels effets secondaires qui n’auraient pas été décelés dans les phases précédentes. Dans ce cas, la nouvelle molécule est immédiatement retirée du marché.