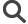Le récepteur A2A pour trier les synapses
Grâce à un microscope à super-résolution acquis grâce à l’Appel à Projets Rotary-Espoir en Tête 2014, une nouvelle étape a été franchie dans la compréhension du fonctionnement des neurones au cours du développement postnatal. A terme, cette découverte permettrait de mieux comprendre le fonctionnement des maladies neurodégénératives comme la maladie d’Alzheimer.
Cette découverte a fait l’objet d’une publication au sein de la prestigieuse revue « Science ».
Au cours du développement postnatal de l’hippocampe (chef d’orchestre de la mémoire), les connexions synaptiques entre neurones sont produites en surnombre. Seules les synapses actives, c’est-à-dire le lieu où les neurones communiquent entre eux en libérant des neurotransmetteurs, sont maintenues. Le mécanisme par lequel le cerveau en développement se débarrasse des synapses en surnombre est révélé dans une étude, récemment publiée dans la revue Science (le 5 novembre 2021) et réalisée de manière conjointe par le groupe de Sabine Lévi (Institut du Fer à Moulin, Sorbonne Université/Inserm, Paris) et de Christophe Bernard (Institut de Neurosciences des Systèmes, Aix-Marseille Université/Inserm), grâce au financement de l’Association Rotary – Espoir en Tête et l’expertise du Conseil Scientifique de la Fédération pour la Recherche sur le Cerveau.
Les scientifiques montrent la contribution du récepteur de l’adénosine de type 2A (A2A) localisé au niveau des synapses. Ce récepteur s’active lorsque des molécules d’adénosine (un produit de transformation de l’ATP), libérées par les neurones, viennent s’y fixer. En l’absence d’une libération d’adénosine et donc d’activation du récepteur A2A pendant plus de 20 minutes, les synapses sont rapidement éliminées. Les pics de libération d’adénosine et d’expression du récepteur A2A diminuent dans la plupart des régions du cerveau après la phase critique de la formation des synapses (synaptogenèse). Cette synaptogenèse connaît un rythme accéléré jusqu’à l’âge de 5-7 ans puis se stabilise à un niveau bas tout ou long de la vie.
La caféine, substance psychoactive la plus couramment consommée dans le monde, y compris pendant la grossesse et l’allaitement, est un bloqueur naturel du récepteur A2A qui ne peut donc plus être activé. L’exposition à la caféine pendant cette période pourrait déclencher la suppression de certaines synapses, avec des effets délétères à long terme. Des données du laboratoire montrent qu’une exposition transitoire à la caféine pendant cette phase péri-natale (proche de la naissance), période cruciale associée au remaniement synaptique, amènerait à des déficits cognitifs. De plus, des travaux récents ont montré qu’une surexpression anormale du récepteur A2A dans le cerveau âgé serait corrélée au déclin de la fonction synaptique et donc à la neurodégénération.
Des études futures diront si le mécanisme identifié ici de stabilisation/élimination des synapses au cours du développement est réactivé dans les maladies neurodégénératives comme la maladie d’Alzheimer et si le ciblage de cette voie pourrait limiter la perte synaptique et le déclin cérébral.
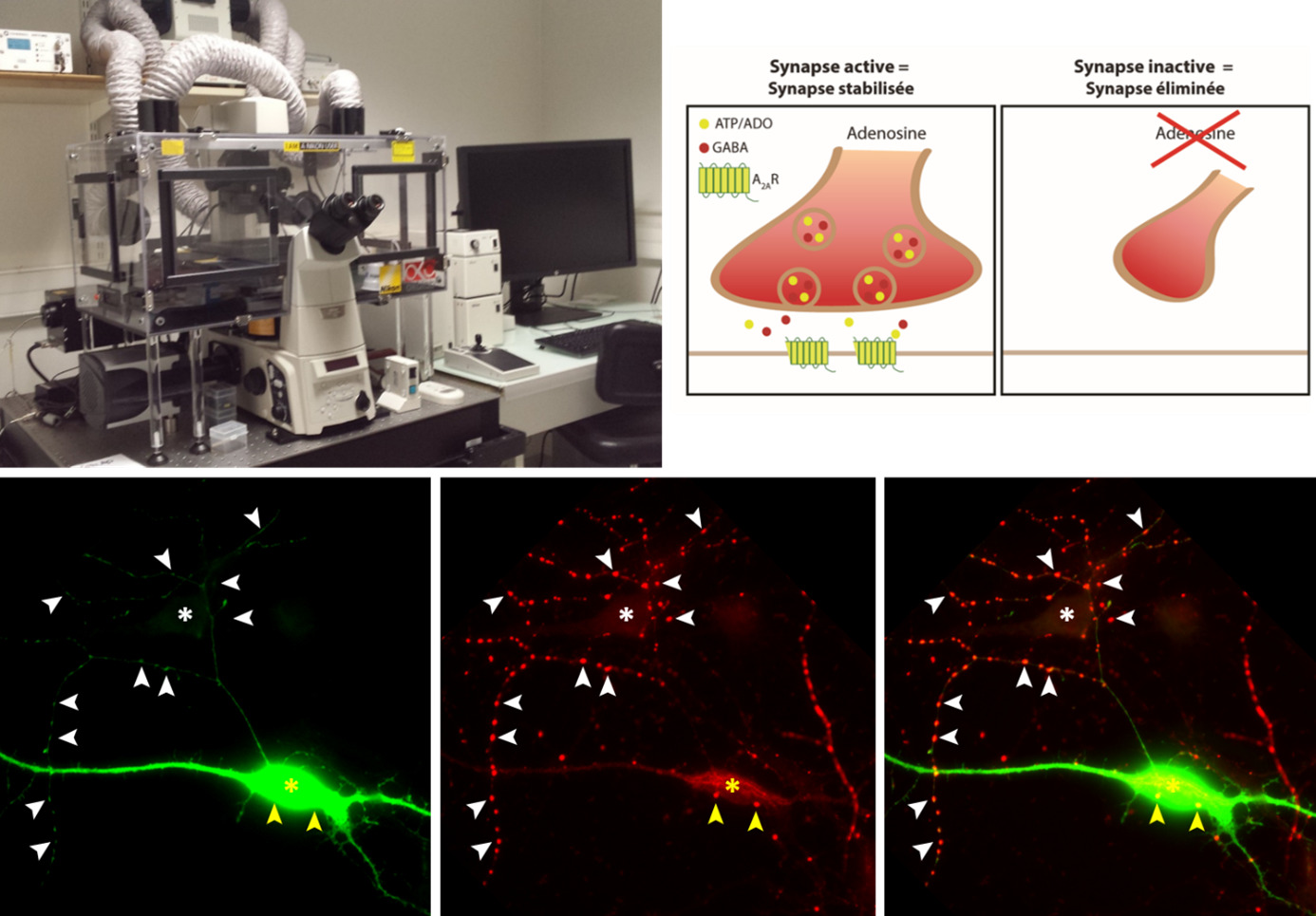
Photographies : Ferran Gomez-Castro & Sabine Lévi
Légende :
En haut : microscope à super-résolution acquis grâce à un financement de la FRC-Rotary Club 2014.
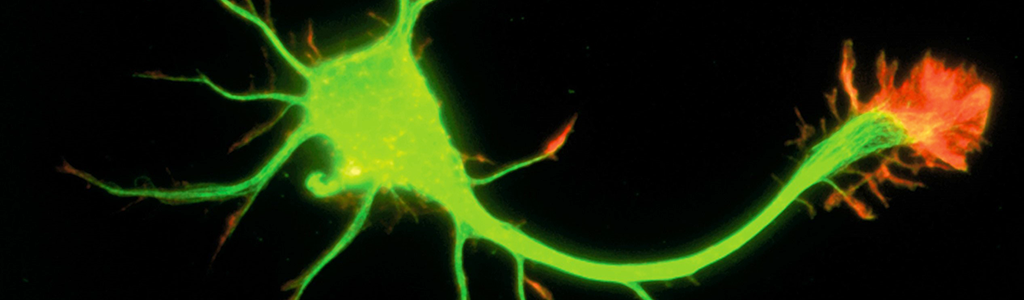
En bas : Images montrant un neurone qui a perdu ses synapses GABAergiques en l’absence du détecteur d’activité.
En rouge : les synapses GABAergiques ; en vert : un neurone dans lequel le récepteur A2A a été supprimé. Le neurone qui n’exprime plus le récepteur A2A n’a que quelques connexions synaptiques (flèches jaunes) autour de son corps cellulaire (étoile jaune). En revanche, un neurone non fluorescent, situé à proximité du neurone vert et dans lequel le récepteur A2A est conservé présente un grand nombre de synapses (flèches blanches) autour de son corps cellulaire (étoile blanche) et le long de ses ramifications.
—
Publication : « Convergence of adenosine and GABA signaling for synapse stabilization during development » – Revue Science – 5 novembre 2021
Rédaction : Sabine Lévi, Directrice de Recherche à l’Institut du Fer à Moulin (IFM) et co-responsable de l’équipe « Plasticité des réseaux corticaux et épilepsie ».
Photographie : Croissance d’un neurone – Inserm

Sabine LEVI
Directrice de recherche CNRS depuis 2015, Sabine Levi co-dirige actuellement l’équipe « Plasticité des réseaux corticaux et épilepsie » avec Jean-Christophe Poncer, à l’Institut du Fer à Moulin à Paris. Elle s’intéresse particulièrement aux mécanismes cellulaires et moléculaires à la base de la formation et de la régulation des synapses (zone d’interaction entre deux neurones, permettant la transmission d’un signal) inhibitrices du cerveau. Elle a entre autres développé une technique de suivi de particules uniques à base de nanocristaux, qui a permis de montrer que les récepteurs sont très mobiles et s’échangent entre les synapses.
L'équipement du projet financé
Découvrez l’équipement sélectionné par le Conseil Scientifique de la FRC et financé par l’Association Rotary-Espoir en Tête en 2014 en cliquant ici.