Les vecteurs viraux, une aide précieuse pour la recherche
Agents infectieux pouvant provoquer des maladies chez l’Homme comme la grippe, l’hépatite ou plus récemment le Covid-19, les virus sont des particules microscopiques qui pénètrent dans nos cellules et utilisent ses composants pour se répliquer et propager l’infection virale dans l’organisme. Mais les propriétés des virus en font également de formidables outils pour la recherche fondamentale et clinique. Ils sont ainsi utilisés de façon modifiée pour faire pénétrer un ADN étranger dans une cellule : on parle alors de vecteurs viraux.
Qu’est-ce qu’un vecteur viral ?
Le virus, du fait de sa simplicité extrême, ne peut se répliquer par lui-même. En infectant une cellule hôte, il va donc détourner à son profit la machinerie cellulaire pour se multiplier. Pour se faire, il incorpore son matériel génétique à l’intérieur de la cellule, et celle-ci va permettre de produire de nouveaux virus. C’est cette propriété d’incorporation de l’ADN à la cellule hôte qui est couramment utilisée en biologie moléculaire. Un vecteur viral est donc une molécule d’ADN contenant un gène d’intérêt (ou une construction génétique d’intérêt) qui va être délivrée dans les cellules hôtes visées. Pour produire un vecteur viral, l’ADN du virus est modifié d’une part pour porter l’ADN étranger à délivrer à un type cellulaire donné, et d’autre part pour ôter les séquences qui codent les protéines permettant la multiplication du virus. Ainsi, le vecteur viral délivrera l’ADN étranger aux cellules hôtes ciblées, mais il ne pourra pas se répliquer et donc provoquer une infection virale dans l’organisme.
Les vecteurs viraux peuvent être utilisés aussi bien sur un organisme vivant que sur des cellules en culture. Il existe différents types de vecteurs viraux, ayant tous leurs avantages et leurs limites en fonction des expérimentations. Les plus couramment utilisés sont les rétroviraux, les lentiviraux, les adénoviraux et les virus adéno-associés. Ils permettent notamment d’insérer un morceau d’ADN plus ou moins grand, de façon plus ou moins stable, dans des cellules en division ou non, avec un taux d’expression du gène inséré plus ou moins élevé. Ces vecteurs peuvent être intégratifs ou non, c’est-à-dire qu’ils peuvent soit intégrer leur ADN dans le génome de l’hôte, qui sera alors transmis aux cellules filles, soit seulement faire pénétrer le matériel génétique dans la cellule sans l’intégrer à l’ADN. Le gène apporté s’exprimera alors durant toute la vie de la cellule et disparaîtra avec la mort de celle-ci. Enfin en général, ces vecteurs intègrent souvent une construction permettant de distinguer les cellules ayant incorporées le nouvel ADN des autres, afin de s’assurer de l’infection virale désirée.
Intérêts de l’utilisation des vecteurs viraux en recherche
Les vecteurs viraux sont largement utilisés en recherche fondamentale mais également en recherche clinique pour la thérapie génique.
- La recherche fondamentale:
Depuis les années 70, l’utilisation des vecteurs viraux a révolutionné la recherche fondamentale. Grâce à cette technique, il est désormais possible par exemple de marquer des gènes d’intérêt grâce à des molécules fluorescentes. Il en existe plusieurs mais la molécule fluorescente la plus couramment utilisée est la GFP (pour Green Fluorescent Protein), une protéine qui émet une fluorescence de couleur verte. Ainsi, par observation au microscope à fluorescence, les cellules exprimant le gène marqué par la GFP seront directement observables. Les chercheurs peuvent ainsi marquer et suivre l’expression de différents types cellulaires, comme les différentes classes de neurones.
Il est également possible grâce aux vecteurs viraux de faire exprimer des morceaux d’ADN permettant d’inactiver la production d’un gène précis. Ce processus est très utile pour comprendre la fonction des gènes, car c’est en les inactivant qu’il est alors possible d’observer les altérations que cela engendre, au niveau cellulaire ou moléculaire mais aussi à l’échelle de l’organisme entier. Cette technique est donc très employée dans le but par exemple de détecter de nouveaux mécanismes impliqués dans des pathologies neurologiques.
Depuis une dizaine d’années, les vecteurs viraux sont aussi largement utilisés dans un nouveau domaine de recherche : l’optogénétique, qui, comme son nom l’indique, allie l’optique à la génétique. Ce procédé permet de rendre des populations neuronales sensibles à la lumière grâce à l’insertion dans le génome d’une protéine photo-activable, appelée opsine. Grâce à une fibre optique délivrant une lumière de longueur d’onde définie et implantée dans le cerveau, les neurones peuvent être « activés » ou « inhibés » en fonction de la nature de l’opsine utilisée. La lumière fonctionne donc ici comme une sorte d’interrupteur, qui permet un contrôle temporel puisque les neurones sont activés (ou inhibés) seulement lorsque la lumière est allumée. L’utilisation des vecteurs viraux permet aux cellules infectées de synthétiser l’opsine, qu’elles ne produisent pas en temps normal. Cette approche apporte donc une précision également spatiale, car seule la population neuronale ciblée par le virus, dans une région cérébrale bien définie, produira l’opsine.
- La thérapie génique:
Plus récemment, les scientifiques se sont intéressés à l’utilisation des vecteurs viraux pour la thérapie génique. La thérapie génique a été conçue au départ pour adresser un gène sain en remplacement d’un gène défectueux à l’origine d’une pathologie liée au dysfonctionnement d’un seul gène, comme la myopathie de Duchenne. Depuis une vingtaine d’années, les stratégies se sont multipliées afin d’utiliser la thérapie génique pour tenter de soigner de nombreuses maladies, dont les maladies neurologiques. Par exemple, cette technique peut aussi être utilisée pour faire exprimer un ou plusieurs gènes par d’autres cellules qui ne les expriment pas naturellement, afin de produire la molécule manquante dans une maladie. Ainsi, un nouvel espoir pour la maladie de Parkinson consiste à reprogrammer les cellules gliales (cellules nerveuses entourant les neurones) afin qu’elles produisent le neurotransmetteur, à la place des neurones dopaminergiques qui dégénèrent dans cette maladie (voir encadré à droite pour découvrir notre page sur ce sujet). De nombreux essais cliniques de thérapies géniques sont en cours dans le monde et plusieurs médicaments issus de cette technologie ont déjà vu le jour. Les vecteurs viraux, qui permettent d’apporter le matériel thérapeutique aux cellules du patient, sont impliqués dans plus de 75% des essais cliniques de thérapie génique*.
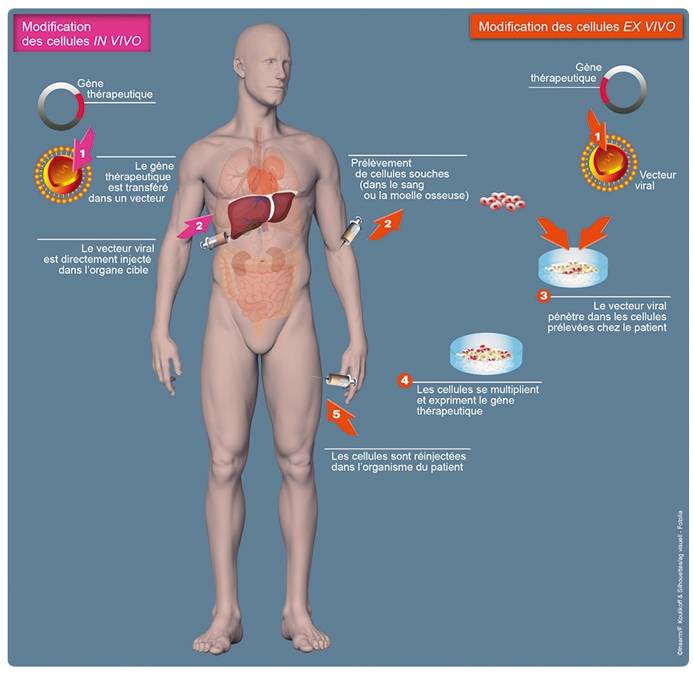
Les deux principales stratégies de thérapie génique. La thérapie génique consiste à modifier génétiquement des cellules d’un patient, pour soigner ou prévenir une maladie. Grâce aux vecteurs viraux, les cellules peuvent être modifiées in vivo, directement dans l’organisme du patient, ou ex vivo. Dans ce second cas, des cellules souches sont prélevées chez le patient, modifiées en laboratoire, puis réinjectées.
Sources :
*Inserm – Article « Thérapie génique – Une recherche de longue haleine qui porte ses fruits » – 1er juin 2018.
Rédaction : Céline Petitgas, chargée des actions scientifiques de la FRC.
Image : Copyright © Inserm, F. Koulikoff.
_____
Pour recevoir les actualités de la recherche, inscrivez-vous à notre newsletter :

La recherche scientifique continue!
Pendant la crise sanitaire que nous vivons actuellement, les chercheurs ont besoin plus que jamais que nous restions mobilisés afin de les soutenir.
L’urgence du moment est de contrer l’épidémie du coronavirus et de soigner les patients pour limiter nos populations malades, mais les chercheurs sur les maladies du cerveau doivent pouvoir aussi continuer leurs recherches ! Les maladies du cerveau persistent et la recherche dans le but de les guérir est une urgence permanente.
Nous comptons sur votre soutien et votre solidarité.

Découvrez le projet du Pr. Daniel Zytnicki, sélectionné par le Conseil scientifique de la FRC et financé grâce au Rotary « Espoir en Tête »
Ce financement a permis d’équiper la Fédération de Recherche en Neurosciences des Saint-Pères (nouvellement rattachée au Centre de Neurosciences Intégrative et Cognition des Saint-Pères) avec une plateforme d’injections virales. Cette nouvelle plateforme est un atout majeur pour le Centre de Recherche qui peut dorénavant modifier les communications dans des populations neuronales ciblées, afin d’étudier les conséquences fonctionnelles de ces modifications dans les modèles expérimentaux (maladie de Charcot, maladie d’Alzheimer, épilepsie…). Leur but est de découvrir de nouveaux mécanismes impliqués dans le fonctionnement normal du cerveau et dans des pathologies neurologiques et psychiatriques.