La mouche : un modèle pour étudier la maladie de Parkinson
Mise à jour de la page : le 23/11/2020
Porteur de projet : Dr Serge Birman – Unité « Plasticité du Cerveau » de l’ESPCI, Paris
Titre du projet : « Implication de la signalisation Hedgehog et de l’autophagie dans l’intégrité et la survie des neurones dopaminergiques au cours du vieillissement cérébral normal et pathologique chez la drosophile »
Subvention attribuée par la FRC en 2017 : 50 000 €
Description du projet
La maladie de Parkinson se caractérise au niveau cellulaire par l’accumulation d’agrégats de protéines dans les neurones dopaminergiques d’une région cérébrale, la substance noire, et par la perte progressive de ces neurones. La mouche drosophile (également appelée mouche du vinaigre) est un organisme modèle important pour étudier les maladies neurodégénératives. L’expression d’une protéine clé de la maladie de Parkinson, l’α-synucléine, dans les neurones de drosophile, reproduit les symptômes de cette maladie, entraînant des déficits locomoteurs. L’équipe du Dr Serge Birman étudie les mécanismes de cette pathologie à l’aide de ce modèle depuis plusieurs années.
La voie de signalisation* de la protéine Hedgehog, découverte chez la drosophile il y a une vingtaine d’année, intervient dans le développement embryonnaire de tous les animaux. L’équipe du Dr Pascal Thérond, qui participe à ce projet, a récemment observé que les neurones dopaminergiques de la drosophile étaient gravement altérés suite à une inactivation de la voie de signalisation Hedgehog, entraînant des effets délétères sur la locomotion et la longévité.
Le projet collaboratif proposé par ces deux équipes vise à élucider les mécanismes neuroprotecteurs de la protéine Hedgehog au cours du vieillissement et dans la maladie de Parkinson. Les expériences auront pour but en particulier d’étudier le rôle de l’autophagie, un processus qui permet à la cellule de digérer une partie de son contenu et qui est essentiel dans les effets observés.
Les résultats
« Les expériences effectuées sur un organisme modèle, la drosophile, n’avaient jamais été réalisées auparavant et ont apporté des connaissances entièrement nouvelles, mettant en lumière l’implication de la voie de signalisation Hedgehog dans les interactions entre neurones et cellules gliales chez l’adulte, et son rôle, ainsi que celle d’une importante voie de dégradation cellulaire, l’autophagie, dans le maintien et la protection des neurones dopaminergiques. » – Serge Birman, porteur du projet
1/ L’autophagie, une voie de neuroprotection pour la maladie de Parkinson ?
Les chercheurs ont tout d’abord étudié en détail la voie de l’autophagie et son potentiel rôle neuroprotecteur sur les neurones dopaminergiques chez un modèle drosophile de la maladie de Parkinson. Leurs résultats montrent qu’une activation de l’autophagie par l’expression dans tous les neurones d’une protéine lysosomale humaine, LAMP-2, protège les neurones dopaminergiques contre la toxicité de l’α-synucléine. Ceci apporte de nouveaux éléments vers une piste de recherche thérapeutique impliquant l’activation de l’autophagie, ce processus visant à dégrader des composants indésirables ou endommagés présents dans une cellule.
2/ Des effets neuroprotecteurs de la voie de signalisation Hedgehog sur le système dopaminergique
Par ailleurs, les chercheurs ont découvert qu’une signalisation Hedgehog défectueuse dans les cellules gliales de drosophile (des cellules du cerveau venant en soutien aux neurones) entraîne une réduction de la durée de vie, de l’activité motrice et de l’intégrité neuronale. Concernant cette dernière caractéristique, ils ont en effet pu mettre en évidence que des drosophiles dont la voie Hedgehog est non fonctionnelle présentent une diminution de dopamine et de tyrosine hydroxylase (enzyme de synthèse de la dopamine). De plus, une accumulation d’agrégats protéiques contenant de l’ubiquitine, un signe de vieillissement cellulaire, a également été observée dans les cellules gliales de ces drosophiles (voir photo ci-dessous).
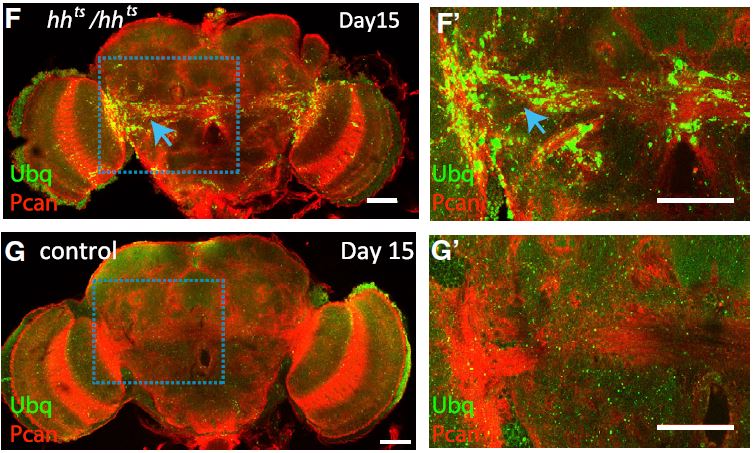
Figure : Des cerveaux de drosophiles contrôles (G, zoom en G’) et mutées pour la voie de signalisation Hedgehog (F, zoom en F’) ont été marqués en vert par un anticorps contre l’ubiquitine. Ces images montrent une accumulation d’agrégats contenant l’ubiquitine (flèche bleue) dans une partie bien distincte du cerveau (les voies gliales du mésencéphale) chez les drosophiles dont la voie de signalisation Hedgehog est défectueuse (F, zoom en F’).
Les chercheurs ont ensuite étudié les mécanismes par lesquels Hedgehog pourrait assurer une neuroprotection. Leurs résultats ont montré que l’activation de la signalisation Hedgehog dans la glie contrôle l’expression de protéines chaperonnes, protéines dont la fonction est d’assister d’autres protéines dans leur maturation, en évitant la formation d’agrégats. Ainsi, la fonction protectrice de Hedgehog serait assurée par la régulation de la protéostase, un ensemble de processus chimiques et biologiques fondamentaux visant à contrôler le réseau de protéines au sein et à l’extérieur de la cellule.
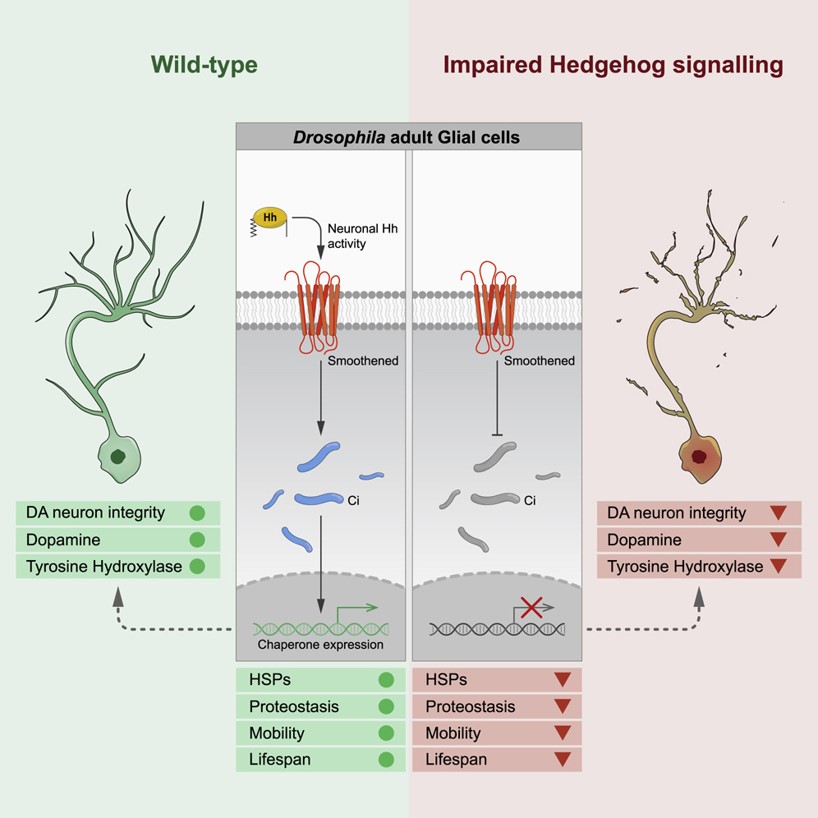
Schéma récapitulatif : Ces travaux ont montré que la signalisation Hedgehog coordonne la détermination de la durée de vie et la protection des neurones dopaminergiques par la régulation de la protéostase gliale pendant la vie adulte chez la drosophile. Ce processus est médié par la régulation des protéines chaperonnes lors de l’activation de la signalisation Hedgehog dans les cellules gliales.
Enfin, les chercheurs ont montré que, dans le modèle de la maladie de Parkinson, l’inactivation de la voie Hedgehog dans les cellules gliales entraîne une augmentation d’un facteur 2 des taux d’α-synucléine dans le cerveau, ce qui suggère que l’α-synucléine s’accumulerait davantage dans ces conditions, vraisemblablement parce qu’elle est moins dégradée, entraînant une neurotoxicité accrue.
L’ensemble des résultats de ce projet montrent que l’activation de la voie de signalisation Hedgehog dans les cellules gliales aurait des effets neuroprotecteurs au cours du vieillissement normal et dans les conditions modèles de la maladie de Parkinson. Plus largement, l’activation de cette voie, qui est conservée chez les mammifères, pourrait avoir des effets bénéfiques dans la lutte contre un large éventail de protéinopathies qui se manifestent par une agrégation aberrante et un mauvais pliage des protéines, comme cela est observé dans la maladie de Parkinson, la maladie d’Alzheimer ou la maladie de Huntington.
Publications
Ces résultats ont donné lieu à la publication de deux articles scientifiques :
- The lysosomal membrane protein LAMP2A promotes autophagic flux and prevents SNCA induced Parkinson disease-like symptoms in the Drosophila. Issa et al., Autophagy 2018.
- Hedgehog Signaling Modulates Glial Proteostasis and Lifespan. Rallis et al., Cell Reports 2020
En parallèle, ce projet a donné lieu à plusieurs communications à des congrès internationaux, en particulier :
- Une présentation orale de Serge Birman au 59th Annual Drosophila Research Conference, à Philadelphie, Etats-Unis, le 12 avril 2018.
- Une présentation orale de Pascal Thérond au 26th European Drosophila Research Conference, à Lausanne, Suisse, le 6 septembre 2019.
Photo de une : ESPCI Paris, © Philippe Fraysseix

Portrait de Serge Birman
Serge Birman est neurobiologiste, spécialiste des systèmes de neurotransmission chez la drosophile. Directeur de Recherche CNRS, il est à la tête de l’équipe « Gènes Circuits Rythmes et Neuropathologies » de l’ESPCI ParisTech. Leurs recherches ont pour objectif de comprendre comment le cerveau contrôle l’activité motrice et par quels mécanismes le vieillissement ou certaines pathologies neurodégénératives, comme la maladie de Parkinson, altèrent cette fonction.
« Mon rêve est que nous finissions par comprendre les causes premières du dysfonctionnement et de la disparition des neurones dans la maladie de Parkinson, parce que cela pourrait conduire au développement d’un traitement curatif de cette maladie. » – Serge BIRMAN

Le centre de recherche
Fondée en 1882 à Paris, l’École supérieure de physique et de chimie industrielles de la ville de Paris (ESPCI) est une grande école d’ingénieurs qui forme, par la recherche, à la physique, chimie et aux métiers d’ingénieur. En complément de sa mission d’enseignement, l’ESPCI a pour vocation d’accueillir des laboratoires de recherche en lien étroit avec le CNRS, l’UPMC, l’université Paris Diderot et l’Inserm. Les 9 unités de recherche de l’ESPCI recouvrent des champs disciplinaires extrêmement variés, allant de la biologie à la physique des matériaux quantiques, de la chimie de synthèse aux propagations d’ondes en milieux complexes.
Qu’est-ce qu’une voie de signalisation ?
Une voie de signalisation est une séquence d’étapes impliquant plusieurs molécules, dans une cellule ou à sa surface, qui fonctionnent ensemble pour contrôler les fonctions cellulaires. Les molécules impliquées dans ces échanges assurent trois fonctions : transporter de l’information via des signaux chimiques ; décoder les messages portés par ces signaux grâce à des récepteurs ; enfin, transférer les ordres contenus dans ces messages à la machinerie intracellulaire.
Les voies de signalisation sont importantes dans le contrôle de nombreuses fonctions. Une activation ou une interruption anormale des voies de signalisation peut conduire à divers dysfonctionnement des cellules.

SOUTENEZ LES CHERCHEURS
Pour que la recherche sur les dysfonctionnements du cerveau progresse, vos dons sont indispensables.