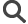Obtenir des ébauches de cerveau en laboratoire : les organoïdes
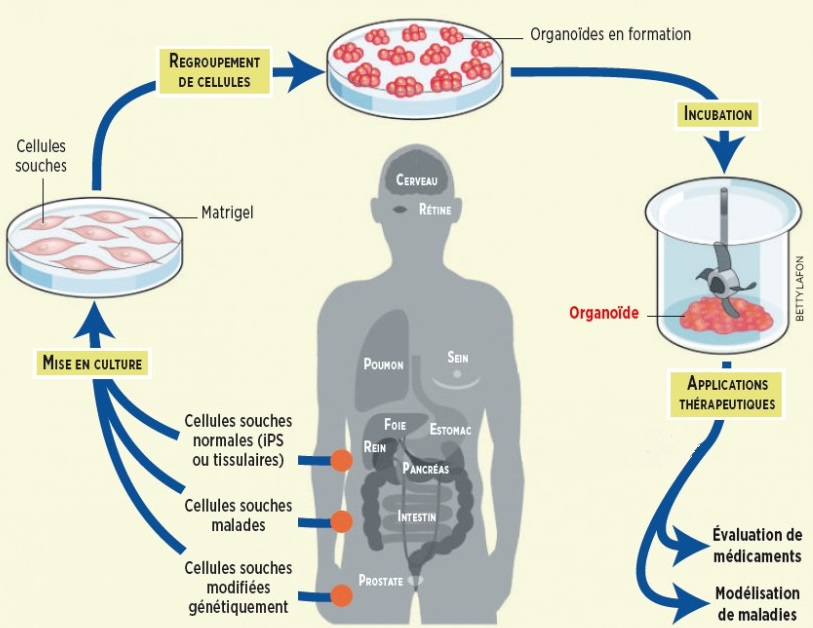
De nos jours, il est possible d’obtenir des neurones dérivés directement de la peau d’individus. Et si la suite était d’obtenir des « mini-cerveaux » ? Des travaux ont en effet permis de montrer que lorsque des cellules souches pluripotentes (iPSC) sont mises en culture sous certaines conditions, elles peuvent former des ébauches d’organes en 3D, appelée organoïdes, visibles sous forme de petites sphères.
Il est difficile d’obtenir et d’étudier du tissu cérébral humain, pour des raisons à la fois pratiques et éthiques. De ce fait, des modèles animaux ont été utilisés comme organismes modèles pour la recherche en neurosciences, malgré certaines différences avec le cerveau humain. Mais récemment, de nouvelles approches ont été développées pour reprogrammer des cellules somatiques humaines d’abord en iPSC puis les différencier en cellules neuronales ayant les mêmes caractéristiques que les neurones du cerveau humain. De plus, la culture de neurones dans les conditions standard in vitro, en deux dimensions a permis de nombreuses avancées, mais le cerveau ayant une organisation complexe en trois dimensions (3D), ces cultures 2D ne peuvent en constituer qu’un modèle d’étude incomplet. D’autres modèles, qui récapitulent l’arrangement structural du cerveau en 3D, se devaient donc être développés.
C’est désormais chose faite puisque des conditions expérimentales appropriées ont été mises au point pour l’obtention in vitro, toujours à partir de cellules souches pluripotentes, de structures organisées en tout point semblables à celles existant dans le cerveau. En effet, sous ces conditions, les cellules humaines sont capables de s’auto-organiser pour construire spontanément des structures en 3D ressemblant à des mini-cerveaux, appelées organoïdes.
Obtention et caractéristiques
Les organoïdes cérébraux sont communément obtenus en permettant aux cellules souches pluripotentes de se différencier et former des agrégats de milliers de cellules dans des boîtes de culture à faible adhésivité. Selon le protocole de Lancaster et coll., les agrégats cellulaires sont enclavés dans une matrice extracellulaire d’échaffaudage appelée Matrigel qui permet la croissance et l’extension d’un bourgeon neuro-épithelial. En l’absence de facteurs exogènes, des zones représentant différentes régions du cerveau (avec une grande variété de neurones) se développent ensuite spontanément dans un même organoïde cérébral. L’ajout de certains facteurs exogènes au milieu de culture peut conduire à des organoïdes correspondant à une région cérébrale spécifique comme l’hippocampe par exemple.
Les organoïdes semblent donc récapituler l’organisation cellulaire du cerveau humain qui se « sépare » en régions cérébrales distinctes au cours du développement. Ils peuvent mesurer jusqu’à 4 mm de diamètre, avec l’équivalent de lobes cérébraux contenant des cavités remplies de fluide, ressemblant aux ventricules du cerveau. Des neurones apparaissent en environ 20 jours, et l’expression génétique y est proche de celle du cerveau humain in vivo.
Applications
Les organoïdes cérébraux sont donc des outils pour la compréhension du développement du cerveau et des maladies liées à cet organe. Ils peuvent être utilisés pour modéliser la pathologie d’une catégorie spécifique de patients, voire celle d’un patient en particulier, en démarrant le protocole avec ses propres cellules souches. En suivant le développement des organoïdes qui en dérivent et en identifiant leurs caractéristiques bio-moléculaires, il est alors possible d’étudier très précisément tel ou tel phénotype pathologique en laboratoire. Cette approche a déjà été utilisée pour étudier la microcéphalie, les troubles du spectre autistique, l’effet du virus Zika sur le développement du cerveau et la maladie d’Alzheimer. En plus d’une meilleure connaissance des processus physiopathologiques en cause, ces modèles pourraient permettre à l’avenir de développer des stratégies thérapeutiques innovantes, et de tester directement l’efficacité de nouveaux médicaments.
Amélioration du modèle
La plupart des modèles organoïdes sont maintenus en culture pendant quelques jours à quelques semaines, et sont utilisés pour étudier principalement le développement précoce du cerveau. Pour modéliser des évènements plus tardifs, les chercheurs avaient besoin de générer des organoïdes du cerveau humain plus matures. Or cette année, une équipe américaine y est parvenue avec la mise au point d’un protocole permettant la croissance et le développement d’organoïdes cérébraux sur des périodes de 9 mois et plus. Une nouvelle étape est donc franchie pour une meilleure compréhension des processus bio-moléculaires qui sous-tendent la construction du cerveau et ses altérations dans des pathologies du cerveau.
Mais d’autres optimisations du protocole restent à réaliser. De fait, les organoïdes sont des structures dont l’hétérogénéité mal contrôlée (notamment d’un individu à un autre dans un même groupe pathologique) en limite l’intérêt. Par ailleurs, les organoïdes ne reflètent pas les altérations épigénéitiques qui surviennent in vivo et qui contribuent au développement de pathologies. Des travaux en cours laissent espérer que de nouvelles conditions in vitro permettront prochainement d’étudier des modèles plus physiologiques, avec, par exemple, le développement d’un réseau vasculaire ou encore la différenciation de cellules microgliales au sein de ces organoïdes.
Ainsi le modèle « organoïde » est une grande avancée rendant possible l’obtention d’un tissu analysable proche de celui du cerveau en développement. Les progrès actuels laissent à penser que ce modèle contribuera à une meilleure connaissance des processus physiopathologiques en cause tout particulièrement dans les maladies neuro-développementales (troubles du spectre autistique, schizophrénie et autres désordres psychiques…) voire neurodégénératives. Cependant, aucun système in vitro ne peut à lui seul refléter la complexité de l’in vivo.
Rédaction : Laura Gouder avec la contribution de Michel Hamon
Publications :
– Adegbola A. et al. Concise review : induced pluripotent stem cells models for neuropsychiatric diseases. Stem Cells Translational Medicine. 2017 ; /dx.doi.org/10.1002/sctm.17-0150.
– Lancaster M.A., Renner M., et al. Cerebral organoids model human brain development and microcephaly. Nature. 2013 ; 501:373–379.
– Lee C-T. et al. 3D brain Organoids derived from pluripotent stem cells: promising experimental models for brain development and neurodegenerative disorders. Journal of Biomedical Science. 2017 ; 24:59.
– Quadrato G. et al. Cell diversity and network dynamics in photosensitive human brain organoids. Nature. 2017 ; 545:48-53.
_____
Pour recevoir les actualités de la recherche, inscrivez-vous à notre newsletter :
Qu’est-ce que l’épigénétique ?
C’est l’étude de la modulation de l’expression des gènes, sans modification de la séquence d’ADN. Les marques épigénétiques sont héréditaires mais réversibles. Concrètement, elles correspondent à des marques biochimiques, par exemple une méthylation d’histones (protéines permettant la compaction de l’ADN).

Un organoïde en boite de culture présentant les caractéristiques d’une région du cerveau humain.
© Image courtesy of The Agency for Science, Technology, and Research (A*STAR)
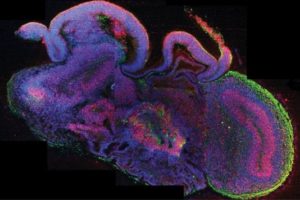
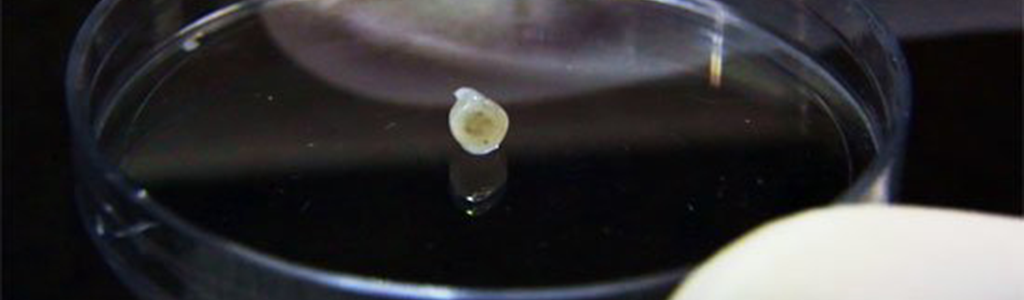
Tissu cérébral humain
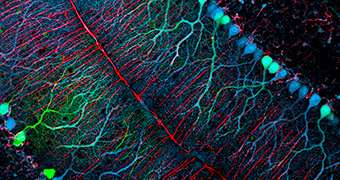
Marquages d’une coupe d’un organoïde cérébrale révélant une morphologie complexe avec différentes régions contenant une diversité de cellules neuronales.
© Lancaster MA.

SOUTENEZ LES CHERCHEURS
Pour que la recherche sur les dysfonctionnements du cerveau progresse, vos dons sont indispensables.